一般的なランダム化比較試験では、新規の介入が既存の標準的介入に比べて優れているかどうかを「優越性試験」というデザインで検証します。事前に定めた臨床的に意味があると考えられる差よりも大きな差が検出されたとき、「有意差あり」と判断され、その新しい介入が臨床で用いられる可能性が出てきます(実際に用いられるかは批判的吟味の結果によります)
優越性試験に平時から慣れ親しんでいる人は分かると思いますが、自身の専門領域で、プラクティスを実際に変えるような優越性試験というのは年にいくつもありません。ほとんどの優越性試験は「有意差なし」という結果になり、「有意差あり」となっても批判的吟味の結果、臨床で採用されずに終わるケースもあります。
優越性試験というのは、例えば新しい薬を使った治療や、今まで行ってきた治療方法よりも手間がかかる治療を検証するために行います。新薬はまだ明らかになっていない副作用を有している可能性がありますし、現行治療にプラスする介入は経済的コスト、労働コストが上乗せされますので、必ず何らかのデメリットがあります。それらのデメリットを帳消しにするほどのメリットが新しい治療には求められますので、「優れている部分がある」ということを検証する必要があるのです。
一方、同じランダム化比較試験でも「非劣性試験」という手法を目にすることがあります。既存の標準治療よりも「劣っていないこと」を検証するタイプの研究です。この手法では、事前に「非劣性マージン」という許容幅を定め、新しい治療法の効果が従来の治療法と比べその許容幅内にあるのであれば、「より優れているとは言えないが劣ってもいない」ということで非劣性を認める、という結論になります。
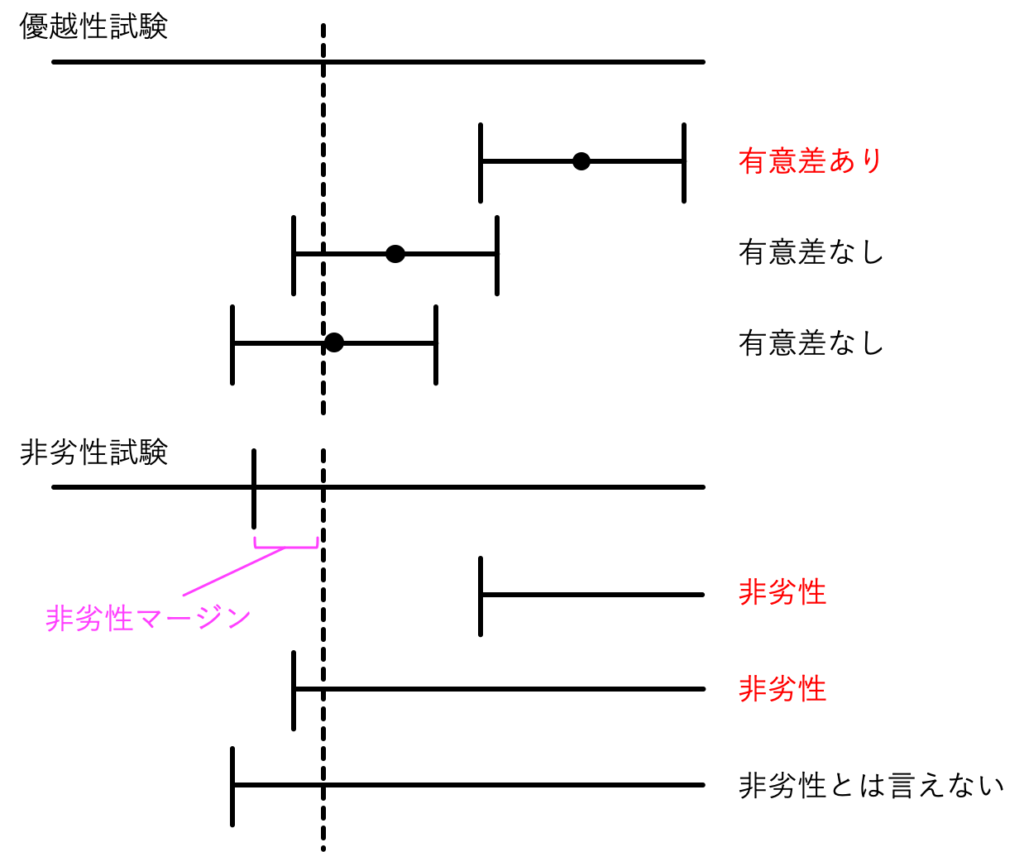
非劣性マージンの存在のため、試験結果が全く同じであっても、優越性試験よりも非劣性試験のほうがポジティブな結果が出やすくなることが上の図から見て取れます。
ではこの「劣性を許容してでもポジティブな結果と解釈する」というのはどのような状況でしょうか。これは、既存の治療と同等かそれ以下の効果しか見込まれないが、同時に既存の治療よりも総合的な害が少なく、この「害の減少」が「効果の減弱」に見合っている場合に限って受け入れられます。考え方の例を挙げれば、
・既存の治療よりもコストが安い
・既存の治療よりも薬剤副作用が少ない
・既存の治療よりも痛みなどの物理的侵襲が少ない
・既存の治療よりも医療者側の労働負担が少ない
といった場合です。科学的な検証結果は別にして具体的な例を挙げると、
・気胸に対して胸腔ドレーンを入れるか、保存的に診るか
・急性虫垂炎に対して外科的切除を行うか、抗菌薬の全身投与だけで診るか
・肺炎の治療開始前に血液培養を採取するか、しないか
・皮下膿瘍のドレナージ後に予防的抗菌薬を投与するか、しないか
といったものがあります。どの代替方法も、効果は劣るかもしれないけれども、先に挙げたような既存の治療にはないメリットを有していることが分かると思います。
では、こちらをご覧ください。
https://galapagos.icu/wp-content/uploads/2020/09/CARAVAGGIO.pdf
こうした研究は本来なら非劣性試験の対象外です。新薬(ここでは新しく適応対象とする薬)のメリットがほとんどないからです。この研究の結果はというと、VTEの発生率に差はなく(非劣性ということは差がないということです)、出血のイベントにも差が見られず、新薬は既存薬よりも高価である、ということになり、新薬を採用する論理的根拠はありません。権威ある科学雑誌に掲載されており、本文中では研究デザインに製薬会社の関与はないと書かれていますが、文末には以下のように書かれていました。
Supported by the Bristol-Myers Squibb–Pfizer Alliance.
Disclosure forms provided by the authors are available with the full text of this article at NEJM.org.
Dr. Agnelli reports receiving lecture fees from Pfizer and Bayer Healthcare and serving as chair of a registry for Daiichi Sankyo; Dr. Becattini, receiving lecture fees and consulting fees from Bayer Healthcare, Bristol-Myers Squibb, and Daiichi Sankyo; Dr. Meyer, receiving grant support and travel support from Leo Pharma, Bristol-Myers Squibb–Pfizer, Stago, and Bayer Healthcare; Dr. Muñoz, receiving grant support, consulting fees, lecture fees, advisory board fees, and travel support from Sanofi and Celgene, lecture fees and advisory board fees from AstraZeneca, Servier, Bristol-Myers Squibb–Pfizer, Daiichi Sankyo, Bayer, and Merck Sharp & Dohme, lecture fees, advisory board fees, and travel support from Roche, grant support, lecture fees, and advisory board fees from Leo Pharma, advisory board fees from Halozyme, lecture fees and travel support from Amgen, lecture fees from Rovi and Lilly, and travel support from Merck Serono; Dr. Huisman, receiving grant support, consulting fees, and lecture fees from Boehringer Ingelheim, Bristol-Myers Squibb–Pfizer, Bayer Healthcare, Aspen, and Daiichi Sankyo; Dr. Connors, receiving fees for serving on an independent review committee from Bristol-Myers Squibb–Pfizer, grant support, paid to her institution, from CSL Behring, consulting fees from Abbott, and advisory board fees from Portola; Dr. Cohen, receiving fees for serving on an adjudication committee from AbbVie and Boehringer Ingelheim, consulting fees and fees for serving on a committee from Bayer, grant support and fees for serving on a committee from Bristol-Myers Squibb and Daiichi Sankyo Europe, grant support, consulting fees, and fees for serving on a committee from Pfizer, consulting fees from Janssen and Ono Pharmaceutical, consulting fees and fees for serving on a steering committee from Portola Pharmaceuticals, and fees for serving on a steering committee from Exom Group; Dr. Bauersachs, receiving consulting fees and lecture fees from Bristol-Myers Squibb, Bayer, Daiichi Sankyo, and Leo Pharma; Dr. Brenner, receiving advisory board fees from Leo Pharma, Sanofi, ROVI Laboratories, and Bayer Pharmaceuticals; Dr. Torbicki, receiving consulting fees and lecture fees from Bayer and lecture fees and travel support from Pfizer; and Dr. Verso, receiving lecture fees from Bayer Healthcare. No other potential conflict of interest relevant to this article was reported.
平たく言えば、製薬会社が全面的に金を出し、買収した医師に行わせた臨床試験ということです。企業がそれほどにコストをかけて行ったオープンラベルの試験結果でも「非劣性」にしかならないという事実が、既存薬がいかに優秀な治療法であるかを物語っています。
もう一つ、本研究中のグラフは注目に値します。主要評価項目であるVTE再発率を表したグラフですが、0〜20%の部分を拡大表示することで両者の優劣についてミスリードする意図が読み取れます。企業の宣伝広告や三流雑誌、詐欺商法などで用いられる手法で、しっかりとした科学雑誌であればこのような記載はあり得ません。アピキサバンの方が優れているとでも言いたげですが、そもそも本研究はアピキサバンの優越性を示そうとした研究ではありません。「差がない」ことを示せば本来の目的は達成されるのに、このような蛇足を為して論文の価値を毀損しています。ちなみに本研究の掲載誌はNew England Journal of Medicineです。
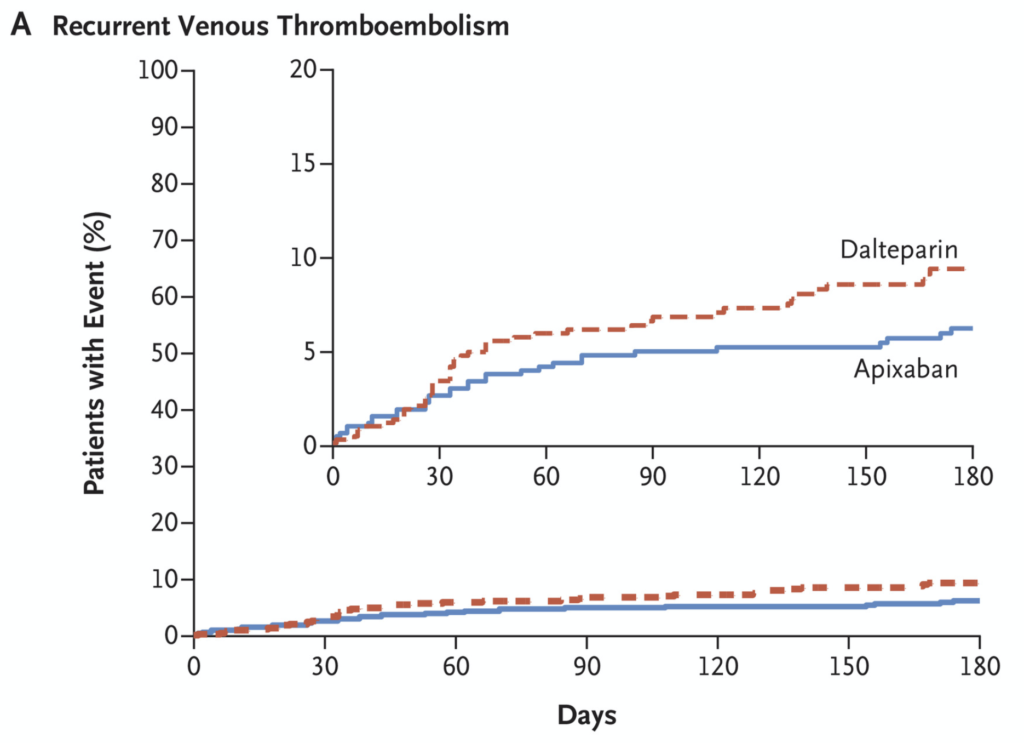
話が逸れましたが、非劣性試験というのは、優越性試験よりもポジティブな結果が出やすいことから、さまざまな場面で悪用されています。既存の標準治療にそもそもどれほどの効果があるか不明な疾患では、極端な話、「何もしなくても」ポジティブな結果を得る可能性すらあります。ですから、検証しようとしている新薬に本当は何の効果もなくても、αエラーによってポジティブな結果を得る可能性が高くなります。非劣性試験にかけられている薬を見たら少なくとも、「その薬には『薬価』と『未知の副作用』を上回るどれほどのメリットがあるのか」を考えてみるとよいでしょう。
参考資料
Apixaban for the Treatment of Venous Thromboembolism Associated with Cancer. N Engl J Med. 2020 Apr 23;382(17):1599-1607.
EM nurd. The Case of the Scientific Ruse. February 11, 2019 by Rory Spiegel
https://emcrit.org/emnerd/the-case-of-the-scientific-ruse/ (accessed on Sep 6th, 2020)
Noninferiority Trials: Is a New Treatment Almost as Effective as Another? JAMA. 2015 Jun 16;313(23):2371-2.


